S Wikipedije, slobodne enciklopedije
VodaOpćenitoHemijski spojDruga imenaMolekularna formulaCAS registarski brojKratki opisOsobine1Molarna masaAgregatno stanjeGustoćaTačka topljenjaTačka ključanjaPritisak pareRastvorljivostDipolni moment
  |
| Voda |
| aqua, dihidrogenmonoksid, hidrična kiselina, vodik-hidroksid |
| H2O |
| 7732-18-5 |
| Tečnost bez mirisa i okusa |
| 18,0153 g/mol |
| tečno (20°C i 1 atm) |
| 0,998 g/cm3(tečnost na 20 °C, 1 atm) 0,917 g/cm3 (led na 0 °C, 1 atm) |
| 0 °C (273,15 K) |
| 100 °C (373,15 K) |
| 2,338 Pa pri 20 °C |
| u haloalkanima, benzenu, višim alkanima, eterima, fenilima, cikloalkanima, alkoholima |
| 1,85 D |
| 1 Gdje god je moguće korištene su SI jedinice. Ako nije drugačije naznačeno, dati podaci vrijede pri standardnim uslovima. |

Video koji pokazuje stanja vode prisutna u svakodnevnom životu.
Voda je providna, bezbojna tekućina koja formira rijeke, jezera, okeane i kišu na Zemlji, i jedan je od osnovnih sastojaka svih živih bića. Kao hemijski spoj, molekule vode sadrže jedan atom kisika i dva atoma vodika, koji su spojeni kovalentnom vezom. Voda je tekućina pri standardnim uslovima temperature i pritiska, ali na Zemlji često se nalazi u svom čvrstom stanju, ledu, kao i u svom plinovitom stanju, vodenoj pari.
Voda prekriva 71% površine planete Zemlje[1] Ona je nezamjenjiva za sve poznate oblike života. Na Zemlji, 96,5% vode se nalazi u morima i okeanima, 1,7% u podzemnim vodama, 1,7% u lednicima i vječnom ledu na Antarktiku i Grenlandu, mali postotak u drugim većim vodenim površinama i 0,001% u atmosferi kao vodena para, oblaci (formirani od čvrstih i tečnih vodenih čestica kondenziranih u zraku) i atmosferske padavine.[2][3] Samo 2,5% vode na Zemlje otpada na slatke vode, a 98,8% slatke vode nalazi se zarobljeno u ledu ili u podzemnim vodama. Manje od 0,3% slatkih voda na Zemlji nalazi se u rijekama, slatkovodnim jezerima i atmosferi, a čak i manji postotak slatkih voda (0,003%) nalazi se sadržan u biološkim oblicima i vještačkim proizvodima.[2]
Voda na Zemlji se stalno kreće kroz ciklus isparavanja, transpiracije i evaporacije(evapotranspiracija), kondenzacije, padavina i otjecanja površinom, obično do mora ili okeana. Isparavanje i transpiranje doprinose količini padavina nad kopnom. Voda koja se koristi pri izračunu proizvodnje roba i usluga poznata je kao virtualna voda.
Voda ispravna i sigurna za piće je nezamjenjiva za ljudi i sva druga živa bića, čak iako im ona ne daje energiju ili organske hranjive materije. Pristup čistoj vodi za piće je poboljšan posljednjih nekoliko decenija u gotovo svim dijelovima svijeta, ali i pored toga još uvijek oko 1 milijarda ljudi nema pristup čistoj vodi a preko 2,5 milijarde ljudi nema pristup adekvatnom načinu zbrinjavanja otpadnih voda.[4] Postoji jasna povezanost između pristupa čistoj vodi i bruto domaćem proizvodu po glavi stanovnika.[5] Međutim, neki istraživači su procijenili da bi do 2025. više od polovine svjetskog stanovništva moglo biti suočeno sa problemima u vezi s vodom.[6]
Izvještaj, objavljen u novembru 2009. sugerira da bi do 2030. u nekim područjima u razvoju, potražnja za vodom mogla nadmašiti njenu ponudu za oko 50%.[7] Voda igra vrlo važnu ulogu u svjetskoj ekonomiji, između ostalog kao otapalo za široki spektar hemijskih supstanci, te kao rashladno sredstvo za industrijske mašine i slično. Oko 70% slatkih voda ljudi koriste za poljoprivredu.[8]
Hemijske i fizičke osobine
|
Glavni članak: Osobine vode |
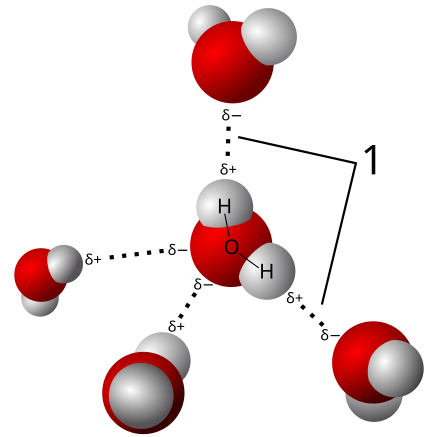
Model vodikovih veza (1) između molekula vode.

Udarac vodene kapi uzrokuje "povratni" mlaz okružen kružnim
kapilarnim valovima.Sniježne pahulje, Wilson Bentley, 1902.

Kapi rose slijepljene na paukovoj mreži.

Kapilarno djelovanje vode u odnosu na živu.
Voda je hemijska supstanca sa hemijskom formulom H2O. Jedna molekula vode ima dva atoma vodika spojena kovalentnom vezom na jedan atom kisika.
Voda u prirodi se javlja u sva tri uobičajena agregatna stanja(čvrsto, tečno i plinovito), a na Zemlji poprima mnoge različite oblike: u njenoj atmosferi nalaze se vodena para i oblaci, u okeanima je morska voda, u polarnim morima su ledeni brijegovi, na planinama lednici, a na površini slana i slatkovodna jezera, rijeke te podzemne vode.
Tabela: Pregled osobina vode u zavisnosti od temperature[9][10][11]Temperatura oCGustoća (g/cm3)Specifičnatoplota (J/g K)Termalnaprovodljivost (mW/K m)
| 0 | 0,99984 | 4,2176 | 561,0 |
| 10 | 0,99970 | 4,1921 | 580,0 |
| 20 | 0,99821 | 4,1818 | 598,4 |
| 30 | 0,99565 | 4,1784 | 615,4 |
| 40 | 0,99222 | 4,1785 | 630,5 |
| 50 | 0,98803 | 4,1806 | 643,5 |
| 60 | 0,98320 | 4,1843 | 654,3 |
| 70 | 0,97778 | 4,1895 | 663,1 |
| 80 | 0,97182 | 4,1963 | 670,0 |
| 90 | 0,96535 | 4,2050 | 675,3 |
| 100 | 0,95840 | 4,2159 | 679,1 |
Osnovne hemijske i fizičke osobine su:
- Voda je tekućina pri standardnim uslovima temperature i pritiska. Čista voda je bez okusa i mirisa. Prirodna, suštinska boja vode i leda je vrlo blaga, nježna nijansa plave, mada su oboje bezbojni u malehnim količinama. Vodena para uglavnom je nevidljiva kao plin.[12]
- Voda je optički tranparentna u vidljivom elektromagnetnom spektru. Zbog toga, vodene biljke mogu živjeti u vodi jer sunčeva svjetlost može doći do njih. Infracrvenu svjetlost jako apsorbiraju veze kisika i vodika (OH veze).
- Pošto molekula vode nije pravolinijska (linearna), a atom kisika ima veću elektronegativnost od atoma vodika, on nosi neznatno veći negativni naboj od vodikovih atoma, dok su vodikovi atom nešto pozitivniji. Kao rezultat, molekula vode je polarna sa električnim dipolnim momentom. Za molekulu njene veličine, voda može formirati neuobičajeno veliki broj međumolekulskih vodikovih veza (četiri). Ovi faktori dali su snažne privlačne sile između molekula vode, dajući ogromni površinski napon[13] i kapilarne sile. Kapilarna akcija se odnosi na tendenciju vode da se kreće prema gore kroz usku cijev protivno sili gravitacije. Ovu osobinu iskorištavaju sve vaskularne biljke, poput drveća.[14]
- Ona je dobro polarno otapalo (rastvarač) i često se spominje kao univerzalno otapalo. Supstance koje se rastvaraju u vodi, npr. soli, šećeri, baze i neki plinovi, naročito kisik i ugljik-dioksid (karboniziranje), smatraju se hidrofilnim supstancama (one koje vole vodu). Druge supstance koje se ne mogu miješati s vodom, npr., masti, ulja (odnosno lipidi) su poznate kao hidrofobne supstance (one koje ne vole vodu).
- Sve komponente u ćelijama (bjelančevine, DNK i polisaharidi) su rastvorljivi u vodi, a svoju strukturu i aktivnost deriviraju iz svog međudjelovanja s vodom.
- Čista voda ima vrlo nisku električnu provodljivost, ali ona se znatno povećava rastvaranjem male količine ionskog materijala u njoj, poput natrij hlorida.
- Tačka ključanja vode (kao i svih drugih tekućina) zavisi od barometarskog pritiska. Naprimjer, na vrhu Mount Everesta voda vrije na 68 °C za razliku od 100 °C na nivou mora na istoj geografskoj širini (pošto promjena geografske širine neznatno mijenja atmosferski pritisak). Nasuprot toga, voda u velikim okeanskim dubinama čak i blizu geotermalnih izbora može dostići nekoliko stotina stepeni ali ostaje u tečnom stanju.
- Sa 4181,3 J/(kg·K), voda ima visok specifični toplotni kapacitet kao i visoku toplotu isparavanja (40,65 kJ·mol−1), a obje osobine su rezultat ekstenzivnih vodikovih veza između molekula vode. Ove dvije neobične osobine omogućavaju vodi da ujednačava klimu na Zemlji tako što smanjuje velika kolebanja temperature.
- Gustoća vode na 4 °C iznosi 1000 kg/m3. Gustoća leda iznosi 917 kg/m3.

ADR oznaka za transport dobara kod kojih postoji opasnost od reakcija s vodom
- Voda je najgušća na temperaturi od 3,98 °C.[15] Većina poznatih supstanci postaju gušće pri opadanju temperature, ali kod vode postoji anomalija pri snižavanju temperature kada se ona hladi do temperature kada prelazi u led. Tokom hlađenja, voda postoje sve gušća do 3,98 °C. Ispod ove temperature, postepeno se formira otvorena ledena struktura u vodi niske temperature, nasumična orijentacija molekula vode u tečnom stanju se održava termalnim kretanjem, a ispod 3,98 °C nema dovoljno termalne energije da se održava ova nasumičnost. Kako se voda hladi, javljaju se dva istovremena efekta: smanjenje zapremine i povećanje ukupne zapremine tečnosti kako se molekule počinju orijentirati u organiziranu strukturu leda. U temperaturnom rasponu između 3,98 °C i 0 °C drugi efekat poništava prvi, tako da je neto efekt povećanje zapremine uz snižavanje temperature.[16] Voda se širi i zahvata 9% veću zapreminu od leda, što konačno izaziva pojavu da led pluta na tečnoj vodi, poput ledenih santi.
- Voda se može miješati sa mnogim tečnostima, poput etanola, u svim omjerima, dajući jedinstvenu homogenu tekućinu. S druge strane, voda i mnoga ulja ne mogu se miješati, ona obično grade slojeve gdje je tečnost manje gustoće u gornjem sloju, a gušća u donjem.
- Voda gradi azeotrope sa mnogim drugim otapalima.
- Ona se može putem elektrolize razdvojiti na vodik i kisik. Energija koja je neophodna da se voda razdvoji na ova dva elementa putem elektrolize ili bilo kojeg drugog procesa je veća od energije koja se dobija kada se vodik i kisik ponovno rekombiniraju. [17]
- Kao oksid vodika, voda se formira kada vodik i spoj koji ga sadrži sagorijeva ili reagirasa kisikom ili spojem koji sadrži kisik. Voda ne spada u goriva, ona je krajnji proizvod sagorijevanja vodika.
- Hemijski elementi koji su više elektropozitivni od vodika poput litija, natrija, kalcija, kalija i cezija mogu istisnuti vodik iz vode, dajući hidrokside. Pošto je vodik zapaljiv plin, on je vrlo opasan te stoga reakcije vode sa nekim od navednih elektropozitivnijih elemenata mogu biti burne i eksplozivne.
- Dužina veze O-H u jednoj (pojedinačnoj) molekuli vode iznosi 0,957854 Å (9,57854 × 10-11 m), a H atomi zatvaraju ugao od 104,5°.[18] Međutim, ovi parametri se neznatno mijenjaju kada se posmatra više molekula, gdje studije pokazuju da je u tom slučaju dužina O-H veze 0,991 Å, a ugao između H-O-H atoma 105,5°.[19]
OsobinaNapomenaZnačaj za okolinu
| Fizičko stanje | Jedina supstanca koja se prirodno na Zemljinoj površini javlja u sva tri agregatna stanja: čvrstom, tečnom i plinovitom | Prijenos toplote između okeana i atmosfere putem promjene agregatnog stanja |
| Mogućnost otapanja | Otapa više supstanci u većim količinama od bilo koje druge uobičajene tekućine | Važna u hemijskim, fizičkim i biološkim procesima |
| Gustoća: masa po jedinici zapremine | Gustoća je određena (1) temperaturom, (2) salinitetom i (3) pritiskom, ovim redom po značajnosti. Temperatura kada je najveća gustoća čiste vode iznosi 4 °C. Za morsku vodu, tačka mržnjenja raste porastom saliniteta | Kontrolira vertikalno kretanje unutar okeana, pomaže distribuiranju toplote i omogućava sezonsku stratifikaciju |
| Površinski napon | Najviši među svim uobičajenim tečnostima | Kontrolira formiranje kapi kiše i oblaka; važan za fiziologiju ćelija |
| Provođenje toplote | Najbolja među svim svakodnevnim tečnostima | Važna u mikroskali, naročito na ćelijskom nivou |
| Toplotni kapacitet | Najviši među uobičajenim tečnostima ali i čvrstim supstancama | Onemogućava ekstremno kolebanje temperature na Zemlji |
| Latentna toplota topljenja | Najviša među tečnostima i veća od mnogih čvrstih supstanci | Termostatski efekat reguliranja toplote zbog otpuštanja toplote tokom smrzavanja i apsorpcije pri topljenju |
| Latentna toplota isparavanja | Najviša među supstancama | Izuzetan značaj, osnovni faktor u prijenosu toplote unutar okeana i između atmosfere i okeana, utječe na klimu i vremenske prilike |
| Indeks prelamanja | Povećava se povećanjem slanosti a smanjuje povećanjem temperature | Objekti u vodi izgledaju bliže nego u zraku |
| Providnost | Relativno velika za vidljivu svjetlost; velika apsorpcija za infracrvenu i ultraljubičastu svjetlost | Važna za fotosintezu |
| Provođenje zvuka | Dobra u odnosu na druge fluide | Omogućava sonarima i drugim detektorima brzo mjerenje dubine vode i otkrivanje izgleda podvodnih struktura i životinja; pod vodom, zvukovi se mogu ćuti na velikim udaljenostima |
| Mogućnost kompresije | Vrlo malehna | Promjena gustoće je mala povećanjem pritiska i dubine |
| Tačke topljenja i ključanja | Neobično visoke | Omogućava da se voda nalazi u tečnom stanju u većini regija na Zemlji |
Okus i miris
Čista H2O je bez okusa i mirisa.
Voda može otopiti mnoge različite supstance, koje joj daju različite okuse i mirise. Ljudi i životinje su razvili osjetila koja im omogućavaju da ocijene može li se voda piti, izbjegavajuću preslanu vodu ili zagađenu.
Ukus mineralne i izvorske vode nastaje zbog minerala koji su u njoj otopljeni, a što se često ističe u marketinškim oglasima. Čistoća vode u izvorima i mineralnim vodama se odnosi na odsustvo otrova, zagađivača i mikroorganizama u njoj, a ne odsustvo minerala koji su prirodno prisutni.
Rasprostranjenost u prirodi
Najveći dio vode u svemiru proizvodi se kao nusproizvod pri formiranju zvijezda. Kada se zvijezda rađa, njeno rođenje je povezano sa snažnim izbacivanjem plina i prašine. Kada ovaj materijal kolidira sa okolnim plinovima, udarni talasi koji nastaju sažimaju i zagrijavaju plin. Zamijećeno je da se voda prilično brzo stvara u ovom vrelom, gustom plinu.[20] Dana 22. jula 2011. objavljen je izvještaj u kojem se navodi otkriće ogromnog oblaka vodene pare koji sadrži 140 triliona puta više vode nego svi Zemljini okeani zajedno, oko kvazaraudaljenog 12 milijardi svjetlosnih godina od Zemlje. Po mišljenju istraživača, ovo otkriće pokazuje da je voda vrlo česta i uobičajena u svemiru tokom gotovo cijele njegove historije.[21][22]
Voda je opažena i u međuzvjezdanim oblacima unutar naše galaksije Mliječni put. Ona možda postoji u velikim količinama i u drugim galaksijama, zbog toga što su njeni osnovni "sastojci", kisik i vodik, među najčešćim i najrasprostranjenijim elementima u svemiru. Zasnovano na modelima formiranja i evolucije Sunčevog sistema i drugih zvjezdanih sistema, većina drugih planetarnih sistema vjerovatno ima slične sastojke.
Voda je prisutna u vidu vodene pare u:
- atmosferi Sunca: u tragovima[23]
- atmosferi Merkura: 3,4%, te ogromne količine vode u Merkurovoj egzosferi[24]
- atmosferi Venere: 0,002%[25]
- Zemljinoj atmosferi: ~0,40% u cjelokupnoj atmosferi, obično 1–4% na površini; kao i u atmosferi Mjeseca u tragovima[26]
- Marsovoj atmosferi: 0,03%[27]
- atmosferi Cerere[28]
- atmosferi Jupitera: 0,0004%[29] – zarobljena u ledu drugih spojeva; kao i na njegovom mjesecu Evropi.[30]
- atmosferi Saturna – zarobljena u ledu drugih spojeva; i na njegovom mjesecu Titanu (u stratosferi), Enkeladu: 91%[31] i Dioni (u egzosferi)
- atmosferi Urana - u tragovima ispod 50 bara
- atmosferi Neptuna - pronađena u dubljim slojevima atmosfere[32]
- atmosferama vansolarnih planeta, uključujući planete poput HD 189733 b[33] i HD 209458 b,[34] Tau Boo b[35], HAT-P-11b[36] [37], XO-1b, WASP-12b, WASP-17b i WASP-19b.[38]
- u atmosferama zvijezda: nije ograničena samo na hladne zvijezde, nego je detektirana i u vrućim gigantima poput Betelgeza, Mu Cephei, Antaresa i Arkturusa.[39][37]
- interstelarnim oblacima: uključujući TW Hydrae,[40] IRC +10216[41] i APM 08279+5255[21][22]
Tečna voda
Tirkizna boja vode sa odsjajem Sunca.
Za tečnu vodu poznato je samo da je prisutna na Zemlji, čije 71% površine prekriva. Naučnici vjeruju da je tečna voda prisutna i na Saturnovim mjesecima Enkeladu, gdje se smatra da se 30-40 km ispod njegove južne polarne površine nalazi okean dubok 10 kilometara,[42][43] te Titanu, kao sloj ispod površine, možda pomiješan sa amonijakom.[44]Tečna voda možda također postoji i na Jupiterovom mjesecu Ganimedu kao sloj stiješnjen pod velikim pritiskom između leda i stijena.[45]
Voda u vidu leda prisutna je:
- na Marsu: pod regolitom i na polovima
- u sistemu Zemlja-Mjesec: uglavnom kao ledeni pokrivač na Zemlji, a na Mjesecu u kraterima i vulkanskim stijenama[46], a NASA je objavila da je njen uređaj Moon Mineralogy Mapper na indijskoj svemirskoj istraživačkoj letjelici Chandrayaan 1 u septembru 2009. godine otkrio molekule vode.[47]
- na Jupiterovim mjesecima: na površini Evrope i Ganimeda
- na Saturnu: u sistemu prstenova planete[48] kao i na površini i omotaču mjeseca Titana i Enkelada
- u sistemu Plutona i Harona[48]
- u kometama i povezanim objektima (iz Kuiperovog pojasa i Oortovog oblaka).
On je također možda prisutan i na:
Voda i drugi smrznuti spojevi vjerovatno sačinjavaju veći dio unutrašnjih struktura planeta Urana i Neptuna, a voda u dubljim slojevima se možda nalazi u obliku ionske vode u kojoj su molekule razdvojene u supu od iona vodika i kisika, a još dublje od toga bi se mogla nalaziti voda u superionskom stanju u kojoj se kisik kristalizira a ioni vodika slobodno se kreću unutar kisikove rešetke.[50]
Postojanje tečne vode, te u manjoj mjeri njenih plinovitih i čvrstih oblika, na Zemlji je od vitalnog značaja za postojanje života na Zemlji kakog poznajemo. Zemlja se nalazi u nastanjivoj zoni Sunčevog sistema, da je imalo bliža ili dalja od Sunca (oko 5% ili oko 8 miliona km), uslovi koji omogućavaju istovremeno prisustvo vode u sva tri agregatna stanja bili bi gotovo nemogući.[51][52]
Zemljina gravitacija omogućava joj da zadrži svoju atmosferu. Vodena para i ugljik dioksidu atmosferi daju joj temperaturni štit (efekat staklenika), pomažući joj da održi relativno stalnu temperaturu površine. Da je Zemlja manja, rjeđa atmosfera bi dopuštala temperaturne ekstreme, i tako onemogućila akumulaciju vode osim na polovima (kao na Marsu). Temperatura na Zemlji je bila prilično stalna tokom geološkog vremena i pored varijacija u nivou zračenja Sunca, što ukazuje da temperaturu Zemlje reguliraju dinamički procesi putem kombinacije stakleničkih plinova i površinskog ili atmosferskog albeda. Ova pretpostavka naziva se Gaia hipoteza.
Agregatno stanje vode na nekoj planeti zavisi od pritiska okruženja, a koji je dalje određen gravitacijom te planete. Ako je planeta isuviše masiva, voda na njoj može biti u obliku leda čak i pri višim temperaturama zbog visokog pritiska uzrokovanog gravitacijom. Takav slučaj je dokazan na egzoplanetama poput Gliese 436 b[53] i GJ 1214 b.[54]
Na Zemlji
|
Glavni članak: Hidrologija |

Voda pokriva 71% Zemljine površine, okeani sadrže 96,5% vode na Zemlji. Ledeni pokrivač na Antarktiku, koji sadrži 61% slatke vode na Zemlji, vidljiv je u donjem dijelu. Kondenzirana atmosferska voda u obliku oblaka, doprinosi albedu Zemlje.
Hidrologija je proučavanje kretanja, rasprostranjenosti i kvalitete vode na Zemlji. Proučavanje distribucije vode naziva se hidrografija. Proučavanje distribucije i kretanja podzemnih voda je hidrogeologija, lednikaglaciologija, unutrašnjih voda limnologija, a distribucija okeana okeanografija. Ekološki procesi sa hidrologijom su u fokusu proučavanja ekohidrologije.
Cjelokupna masa vode koja se nalazi na površini, ispod i iznad površine planete naziva se hidrosfera. Približna zapremina vode na Zemlji (ukupna zaliha vode u svijetu) iznosi 1.338.000.000 km3.[2] Tekuća voda prisutna je u vodenim površinama: okeanima, morima, jezerima, rijekama, potocima, kanalima, barama, močvarama i lokvama. Najveći dio vode na Zemlji je morska voda. Voda se nalazi u atmosferi u sva tri stanja: kao kristali leda, kao vodena para i kišne kapi. Također postoji i kao podzemna voda u izdanima.
Voda je važna u mnogim geološkim procesima. Podzemna voda je prisutna u većini stijena, a pritisak te vode utječe na oblike rasjeda. Voda u Zemljinoj kori je odgovorna za topljenje koje uzrokuje vulkane u zonama subdukcije. Na površini Zemlje, ona je važna za hemijske i fizičke meteorološke procese. Voda, i u znatno manjoj mjeri led, su odgovorni za transport velikih količina sedimentnog materijala koji se odvija na površini Zemlje. Odlaganje prenesenih sedimenata formira mnoge vrste sedimentnih stijena, koje su dio geološke historije Zemlje.
Kruženje vode
Kruženje vode u prirodi (naučno poznato pod nazivom hidrološki ciklus) označava stalnu izmjenu vode unutar hidrosfere, između atmosfere, površinskih voda, voda u zemljištu, podzemnih voda i biljaka.
Voda se bez prestanka kreće kroz svaki od ovih područja hidrološkog ciklusa putem sljedećih transfernih procesa:
- evaporacijom iz okeana i drugih vodenih površina te transpiracijom iz kopnenih biljaka i životinja u zrak.
- padavinama iz vodene pare kondenzirane iz zraka, koje padaju na zemlju ili okean.
- otjecanjem površinskih voda sa kopna nazad u more.
Veći dio vodene pare iznad okeana se vraća ponovo u okean, ali je vjetrovi odnose iznad kopna u približnoj količini i brzini koliko je otječe u more, približno 47 Tt (teratona) godišnje. Iznad kopna, evaporacija i transpiracije doprinose daljnjih 72 Tt godišnje. Padavine, količinom od oko 119 Tt godišnje iznad kopna, imaju nekoliko oblika: najčešća je kiša, snijeg i grad, uz nešto manji doprinos magle i rose.[55] Rosa su male kapljice vode koje se kondenziraju kada vodena para velike gustoće naiđe na hladnu površinu. Rosa se najčešće stvara u jutarnjim satima kada su temperature najniže, neposredno prije izlaska sunca i kada temperatura površine Zemlje počinje rasti.[56] Kondenzirana voda u zraku može također i reflektirati sunčevu svjetlost dajući dugu.
Voda iz vodotoka se najčešće skuplja iz cijelog sliva (drenažnog bazena) i teče u rijeke. Matematički model korišten za simulaciju rijeka ili vodotoka računa parametre toka i kvaliteta vode naziva se hidrološki transportni model. Dio vode se često preusmjerava u navodnjavanje poljoprivrednog zemljišta. Rijeke i mora nude mogućnosti za putovanje i trgovinu. Vodotoci putem erozije mijenjaju izgled okoline stvarajući riječne doline i delte, u kojima nastaje bogato zemljište gdje se mogu izgraditi veliki populacijski centri. Poplavanastaje kada je nisko i ravno zemljište prekriveno vodom. Najčešće se dešava kada se rijeke izliju iz korita ili kada morska voda počne nadirati na kopno. Suša je duži period, često nekoliko mjeseci ili godina, kada određeno područje nema dovoljnu opskrbu vodom. Ovo se dešava kada ono prima manju količinu padavina od uobičajene.
 |
 |
| Zaliv Fundy za vrijeme plime | i oseke |
Jedan dio vodotoka "zarobljen" je neko vrijeme u jezerima i barama. Na višim nadmorskim visinama, tokom zime, kao i na krajnjem jugu i sjeveru, taloži se snijeg i led, koji vremenom narastu u obliku lednika. Voda također ponire u zemljište do podzemnih izdana. Ta voda kasnije dospijeva ponovno na površinu zemlje u riječnim izvorima, ili na neki spektakularni način poput vrelih izvora i gezira. Podzemne vode se često vještački vade iz bunara. Ove zalihe vode su vrlo važne, jer su relativno čiste, a čista i svježa voda je nezamjenjiva za život ljudi i drugih kopnenih živih bića. U mnogim krajevima svijeta izražen je nedostatak svježe i čiste vode.
|
Glavni članak: Morska voda |
Morska voda sadrži u prosjeku oko 3,5% soli, uz male količine drugih supstanci. Fizičke osobine morske vode se razlikuju od osobina slatke vode u nekim osnovnim tačkama. Ona se smrzava na nižoj temperaturi (oko −1,9 °C), a gustoća joj se povećava snižavanjem temperature do tačke mržnjenja, umjesto da dostigne maksimum gustoće pri temperaturi iznad tačke mržnjenja. Slanost vode (salinitet) u velikim morima varira od oko 0,7% u Baltičkom moru do 4,0% u Crvenom moru.
Plima i oseka su ciklični rast i opadanje nivoa mora i okeana, uzrokovano plimnim silama Mjeseca i Sunca koje djeluju na vodene površine. One uzrokuju promjenu dubine mora i vodenih površina u estuarijima, proizvodeći oscilacije u strujama poznate kao plimni tokovi. Izmjene plime i oseke na određenom području rezultat su promjene relativnog položaja Mjeseca i Sunca u odnosu na Zemlju, pojačanog efektima Zemljine rotacije i lokalne batimetrije. Pojas morske obale koja tone pri visokoj plimi, a tokom oseke je iznad nivoa mora naziva se međuplimna zona, važan je ekološki rezultat okeanskih plimnih kretanja.
Utjecaji na život

Oaza je udaljeni izvor vode sa vegetacijom u pustinji.
Pregled procesa fotosinteze i ćelijskog disanja. Voda (desno), zajedno sa ugljik dioksidom (CO2), daje kisik i organske materije (lijevo), koje mogu ponovno sagorijevati do vode i (CO2).
Sa biološke tačke gledišta, voda ima mnoge vrlo važne osobine koje su nezamjenjive za razvoj i opstanak života, što je izdvaja od drugih hemijskih spojeva.
Ona obavlja ovu ulogu tako što omogućava organskim spojevima da reagiraju na način koji na kraju omogućava samoreplikaciju. Svi poznati oblici života na Zemlji zavise od vode. Voda je vitalna također i kao otapalo u koji se otapaju mnoge izlučevine iz organizma kao i nezamjenjivi dio mnogih metaboličkih procesa u organizmu. Metabolizam je suma ukupnog anabolizma i katabolizma. Pri anabolizmu, voda se izdvaja iz molekule (putem enzimskihhemijskih reakcija koje zahtijevaju energiju) da bi prerasle u veće molekule (npr. škrob, trigliceride i bjelančevine za skladištenje energije i informacija). Pri katabolizmu, voda se koristi da razbije veze da bi od većih načinila manje molekule (npr. glukozu, masne kiseline i aminokiseline koje se koriste kao gorivo za dobijanje energije ili neke druge svrhe). Bez vode, ovi specifični metabolički procesi ne bi postojali.
Voda je temelj fotosinteze i disanja. Fotosintetičke ćelije koriste sunčevu energiju za razdvajanje vodika od kisika iz vode. Zatim se vodik kombinira sa CO2 (kojeg biljke uzimaju iz zraka ili vode) gradeći molekulu glukoze i otpuštajući kisik. Sve žive ćelije koriste takvo gorivo i oksidiraju vodik i ugljik da bi ih pretvorile ponovno u energiju otpuštajući u tom procesu vodu i CO2 (ćelijsko disanje).
Voda je također centralna u kiselo-baznoj neutralnosti i funkciji enzima. Kiselina, donator iona vodika (H+, tj. proton), može se neutralizirati bazom, primaocem protona kao što je ion hidroksida (OH−) dajući vodu kao krajnji rezultat. Čista voda se smatra neutralnom, a njena pH vrijednost (negativni logaritam koncentracije iona vodika) iznosi 7. Kiseline imaju pH vrijednost nižu od 7 dok baze imaju ovu vrijednost višu od 7.
|
Glavni članci: Hidrobiologija i Vodene biljke |
Bioraznolikost na koraljnom grebenu

Neke morske diatomeje (silikatne alge)– osnovna grupa fitoplanktona
Površinske vode na Zemlji pune su života. Smatra se da su se najranija živa bića pojavila u vodi, gotovo sve ribe žive isključivo u vodi, a postoji i ogroman broj morskih sisara, poput delfina i kitova. Neke vrste životinja, poput amfibija, provode dio svojih života u vodi, a dio na kopnu. Biljke poput kelpa i algi rastu u vodi, a one su osnova za neke od podvodnih ekosistema. Plankton je općenito osnova okeanskog lanca ishrane.
Vodeni kičmenjaci moraju uzeti kisik da bi preživjeli, a to rade na razne načine. Ribe imaju škrge umjesto pluća, mada neke vrste riba, imaju oboje. Morski sisari, delfini, kitovi, tuljani i drugi, moraju izaći na površinu da bi udahnuli zrak. Neke amfibije mogu apsorbirati kisik preko kože. Beskičmenjaci imaju širok raspon prilagođavanja da bi preživjeli u vodama siromašnim kisikom, uključujući cijevi za disanje (kao kod nekih insekata i školjki) ili škrge (kao kod rakova). Međutim, beskičmenjaci u vodenoj sredini su se razvili tako da većina ima vrlo malehnu ili nikakvu specijalizaciju za disanje u vodi.
Utjecaj na civilizaciju

Fontana u Kennett Squareu, Pennsylvania
Većina ljudskih civilizacija tokom historije je cvjetalo oko rijeka i većih vodenih putova. Mezopotamija, takozvana kolijevka civilizacije, nalazila se između velikih rijeka Eufrata i Tigrisa, a antičko društvo Egipćana potpuno je bilo zavisno od rijeke Nil. Velike svjetske metropole poput Rotterdama, Londona, Montreala, Pariza, New Yorka, Buenos Airesa, Šangaja, Tokija, Chicaga i Hong Konga, svoj uspjeh i razvoj jednim dijelom duguju i lahkoj pristupačnosti do njih vodenim putevima i ekspanziji trgovine koja je time olakšana. Ostrva sa sigurnim, zaklonjenim lukama, poput Singapura, jako su razvijena iz istog razloga. Na mjestima u sjevernoj Africi i Bliskom istoku, gdje je opskrba vodom oskudna, pristup čistoj vodi za piće bio je i bit će osnovni faktor razvoja ljudskih zajednica.
Zdravlje i zagađenje
Program ekologije, student sa državnog Univerziteta Iowa uzima uzorak vode


























































 bglavac
bglavac irida
irida




















































